| 實驗名稱 | 微型電化電池 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 實驗類別 | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 實驗者名稱 | n/a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 實驗目的 | 利用化學電池把化學能轉變為電能 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 實驗原理 | (1)單電池原理: 使氧化反應在一半電池的電極產生,還原反應在另一半電池的電極產生,還原劑放出電子,電子通過導線由氧化劑接收,產生電流,其原理是將化學能轉換成電能,乾電池就是一個好例子。氣化電位高者接伏特計的負極,低者接伏特計的正極。 (2)雙電池原理: (A)將兩個電化電池順向串聯時,總電位為兩電池電位之和。(異極相連時,一電池之陽極與另一電池之陰極相連接) (B)將兩個電化電池逆向串聯時,總電位為兩電池電位之差。(同極相連時,兩電池之陽極相連接,陰極與陰極相連接) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反應 | 丹聶耳電池(Zn-Cu2+) 氧化半反應:Zn→Zn2++2e- 還原半反應:Cu2++2e-→Cu |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
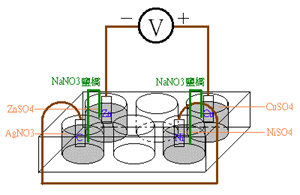
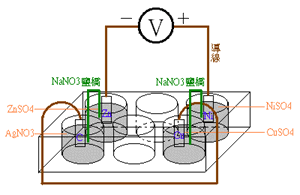
| 實驗儀器 | 六孔井穴板,伏特計,電線(兩端有夾子),多用滴管 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 實驗藥品 | A) Zn片,2M ZnSO4(aq) (A)組半電池 B) Ni片,2M NiSO4(aq) (B)組半電池 C) Cu片,2M CuSO4(aq) (C)組半電池 D) 碳棒,2M AgNO3(aq) (D)組半電池 E) 鹽橋(吸有NaNO3溶液的濾紙條) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 實驗步驟 | (B)AC單電池 -- 以A組作負極,C組作正極,重複以上步驟。 (1)單電池 -- 以上有A、B、C、D四組半電池,兩兩組合可得六個單電池: 包括:AB、AC、AD、BC、BD、CD (A)AB單電池
(C)AD單電池 -- 以A組作負極,D組作正極,重複以上步驟。 (D)BC單電池 -- 以B組作負極,C組作正極,重複以上步驟。 (E)BD單電池 -- 以B組作負極,D組作正極,重複以上步驟。 (F)CD單電池 -- 以C作組負極,D作組正極,重複以上步驟。 (G)在AC單電池中,以碳棒代替負極的Zn片,重複以上步驟。 (H)在AC單電池中,以碳棒代替正極的Cu片,重複以上步驟。 (2)雙電池 (A)順接串聯: 此為鋅-銀電池與鎳-銅電池之順接串聯。 原來(1)Zn是陽極,Ag是陰極。 (2)Ni是陽極,Cu是陰極。
(B)逆接串聯:此為鋅-銀電池與鎳-銅電池之逆接串聯。 串聯後(1)Zn是陽極,Ag是陰極。 (2)Ni是陰極,Cu是陽極。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 實驗結果 | 1)電化電池反應進行中伏特計指針偏轉,一會兒後偏轉逐漸減小。 2)反應後正極金屬片上有沉積物,兩金屬片反應後均失去原本光澤。 (1)單電池
(2)雙電池
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 實驗討論 | n/a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 注意事項 | 1.要把金屬表面的氧化層磨去,直至金屬表面有光澤。 2.鹽橋越短越好,但NaNO3試紙的兩端一定要浸入溶液中,且鹽橋中的電解質最好選擇一些正、負離子移動速度相若的為佳。 3.鹽橋的溶液不可與兩個半電池中的溶液起反應。 |