| 實驗名稱 | 氧化銅之還原 | |||||||||
| 實驗類別 | 1 | |||||||||
| 實驗者名稱 | n/a | |||||||||
| 實驗目的 | 學習以氫氣還原氧化銅並設計一簡易操作的微型裝置 | |||||||||
| 實驗原理 | n/a | |||||||||
| 反應 | Zn+2HCl→ZnCl2+H2 CuO+H2→Cu+H2O |
|||||||||
| 實驗儀器 | 微型分液漏斗、微型15ml錐形瓶 實驗裝置如下: 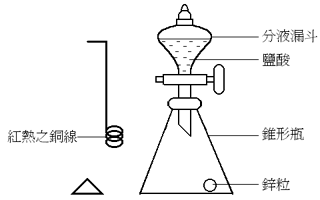 設計特點:利用一分液漏斗在前期作儲存HCl的容器,當酸與鋅
作用後,則成為收集氫的容器。
設計特點:利用一分液漏斗在前期作儲存HCl的容器,當酸與鋅
作用後,則成為收集氫的容器。 |
|||||||||
| 實驗藥品 | 少許鹽酸(1:2)、鋅粒(約0.3克)、銅線一條(末端屈成圈狀) | |||||||||
| 實驗步驟 | 1.把鋅粒放進15ml錐形瓶內,又把鹽酸注入分液漏斗(活栓關上)內至2/3滿,蓋好塞子,與15ml錐形瓶接好,如上圖所示。 2.打開分液漏斗的塞子和活栓,待全部鹽酸流入錐形瓶內,立即蓋上分液漏斗的塞子,使鋅粒與鹽酸在錐形瓶中反應,而分液漏斗的活栓則仍然打開,可讓反應產生的氫氣進入分液漏斗。 3.待反應進行約1分鐘後,反應所產生的氫氣便會充滿整個分液漏斗,此時把銅線用本生燈燒至紅熱,然後打開分液漏斗的塞子,立即把紅熱之銅線由分液漏斗的頂部插入容器內,並觀察銅線在實驗前後之變化 |
|||||||||
| 實驗結果 |
|
|||||||||
| 實驗討論 | n/a | |||||||||
| 注意事項 | 影響實驗結果之因素: 1.若反應的量不足,則銅線會還原得不完全以至影響實驗結果。 2.若把紅熱銅線放進分液漏斗的動作不夠快捷,則銅線會因為溫度降低而導至還原得不完全。 3.若銅線已使用多次 (多次燒至紅熱),由於整條銅線都几乎變成氧化銅,所以氫氣不能把銅線完全還原而導致實驗結果不明顯。 4.若所使用本生燈火焰的碳粒含量過多,則銅線會因為有過多碳粒附於其表面而作出錯誤的判斷。 5.把紅熱的銅線圈插入氫氣中時,要避免接觸容器。 |